브로민화 은
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
브로민화 은(AgBr)은 은과 브로민의 화합물로, 사진술의 감광제로 널리 사용된다. 브로민화 칼륨과 질산 은 수용액을 반응시켜 제조하며, 녹는점은 432°C, 비중은 6.47이다. 물에 거의 녹지 않으며, 사이안화 알칼리, 싸이오황산나트륨, 암모니아수 등 특정 용액에 용해된다. 빛에 의해 분해되는 성질 때문에 19세기부터 사진의 감광제로 활용되었으며, 젤라틴과 같은 보호 콜로이드와 함께 사용되어 사진 필름 및 인화지를 만드는 데 기여했다.
더 읽어볼만한 페이지
- 은 화합물 - 아불화 은
아불화 은은 아이오딘화 카드뮴과 결정 구조는 같지만 이온 위치가 반대이며, 은 원자 간 최단 거리는 299.6 pm이다. - 은 화합물 - 질산 은
질산 은은 은을 질산에 녹여 제조하며, 다양한 용도로 사용되는 무색의 결정성 고체이다. - 브로민화물 - 브로민화 에티듐
브로민화 에티듐은 핵산 검출에 사용되는 형광 화합물로, DNA 및 RNA 검출에 활용되며 아가로스 겔 전기영동 시 DNA 밴드를 확인하는 데 사용되지만, 변이원성이 강해 취급에 주의해야 한다. - 브로민화물 - 브로민화 칼륨
브로민화 칼륨은 칼륨과 브로민의 이온 화합물로, 사진 현상액 억제제, 적외선 분광법 윈도우, 수의학에서의 개 간질 치료제 등으로 사용되지만, 과거 인간 간질 치료제로 사용된 이력은 부작용 문제로 현재는 제한적이다. - 금속 할로젠화물 - 염화 칼륨
염화칼륨(KCl)은 칼륨 이온과 염화물 이온으로 이루어진 이온성 화합물로, 칼륨 비료, 화학 공업, 의학, 사형 집행 등 다양한 용도로 사용되며, 면심입방구조와 광학적 특성을 지니고, 캐나다, 러시아, 벨라루스 등에서 주로 생산된다. - 금속 할로젠화물 - 염화 나트륨
염화 나트륨은 염화물 이온과 나트륨 이온으로 구성된 백색 고체 이온 결정으로, 짠맛을 내며 융점은 800.4℃이고, 다양한 용도로 사용되며 겨울철 제설에도 활용되는 정염의 일종이다.
2. 제법
브로민화 은(AgBr)은 일반적으로 브로민화물 이온(보통 브로민화칼륨을 사용)을 포함한 용액에 질산은 수용액을 반응시켜서 생긴 침전으로서 생성한다.[15]
브로민화 은은 녹는점이 432°C이고 비중이 6.47인 화합물이다. 물에는 거의 녹지 않으며, 20°C에서 용해도는 0.02mg/100ml이다. 사이안화 알칼리, 싸이오황산나트륨 수용액에는 착체를 생성하여 용해되고, 진한 암모니아수에는 소량 용해된다. 또한, 농후한 브로민화물 수용액에도 착체를 생성해 다소 용해된다.[12]
:AgNO3(aq) + KBr(aq) → AgBr(s)+ KNO3(aq)
덜 편리하지만, 염은 그 원소로부터 직접 제조될 수도 있다.
단순하고 빛에 민감한 표면의 현대적인 제조는 젤라틴에 은 할로겐화물 결정을 에멀젼 형태로 만들고, 이를 필름이나 다른 지지대에 코팅하는 것을 포함한다. 결정은 제어된 환경에서 침전되어 작은 균일한 결정(일반적으로 직경 1μm 미만이고 ~1012개의 Ag 원자를 포함)을 생성하며, 이를 알갱이라고 한다.[2]
브로민화물 이온을 포함하는 용액에 질산은 수용액을 첨가하여 침전으로 생성한다.
:
3. 성질
띠틈은 2.5 eV로, 빛에 의해 분해되는 성질을 가지고 있어 사진의 감광제로 사용된다.
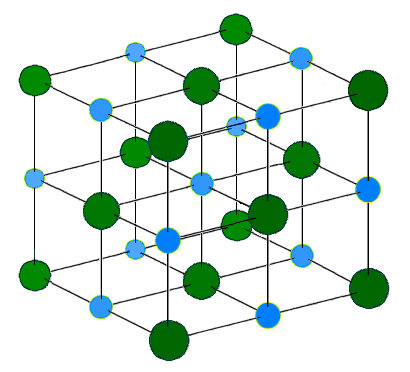
AgF, AgCl, AgBr은 모두 면심 입방(fcc) 암염(NaCl) 격자 구조를 가지며, 격자 매개변수는 다음과 같다:[6]
할로겐화 은은 광범위한 용해도를 가지는데, AgF의 용해도는 AgI의 약 6 × 107배이다. 이는 할로겐 이온의 상대적인 용매화 엔탈피 차이 때문이며, 불화물의 용매화 엔탈피는 이례적으로 크다.[7]
3. 1. 화학적 성질
녹는점은 432°C이고, 비중은 6.47이다. 물에는 거의 녹지 않으며, 20°C에서 용해도는 0.02mg/100ml이다. 용해도곱은 다음과 같다.[12]
: AgBr Ag+(aq) + Br−(aq), ''K''sp = 4×10−13
사이안화 알칼리, 싸이오황산나트륨 수용액에는 착체를 생성해서 용해하고, 진한 암모니아수에는 소량 용해된다. 열 농질산에도 녹는다.
: AgBr + 2 CN− [Ag(CN)2]− + Br−, ''K'' = 1.2×108
: AgBr + 2 S2O32− [Ag(S2O3)2]3− + Br−, ''K'' = 11
: AgBr + 2 NH3 [Ag(NH3)2]+ + Br−, ''K'' = 8×10−6
농후한 브로민화물의 수용액에도 착체를 생성하여 다소 용해된다.
: AgBr + 3 Br− [AgBr4]3−, ''K'' = 3×10−4
띠틈은 2.5 eV이다. 브로민화은은 빛에 의해 분해되기 때문에 사진의 감광제로 19세기부터 이용되고 있다.
브로민화은은 암모니아 수용액과 반응하여 다양한 종류의 아민 화합물을 생성한다.[16]
: AgBr + nNH3 → Ag(NH3)21+
: {AgBr(NH3)2}
: {AgBr2(NH3)2}1-
: {AgBr(NH3)}
: {AgBr2(NH3)}1-
브로민화은은 트리페닐포스핀과 반응하여 트리스(트리페닐포스핀) 생성물을 생성한다.[17][5]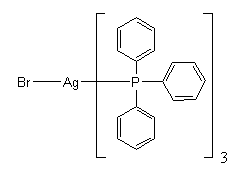
3. 2. 물리적 성질
브로민화 은은 녹는점이 432 °C이고 비중은 6.47이다. 물에는 거의 녹지 않으며, 20°C에서 용해도는 0.02mg/100ml이다.[12] 용해도곱은 다음과 같다.
: ''K''sp = 4×10−13
사이안화 알칼리, 싸이오황산나트륨 수용액에는 착체를 생성하여 용해되고, 진한 암모니아수에는 소량 용해된다. 열 농질산에도 녹는다.
: ''K'' = 1.2×108
: ''K'' = 11
: ''K'' = 8×10−6
농후한 브로민화물의 수용액에도 착체를 생성하여 다소 용해된다.
: ''K'' = 3×10−4
띠틈은 2.5 eV이다. 브로민화 은은 빛에 의해 분해되는 반도체의 일종이다.
AgF, AgCl, AgBr은 모두 면심 입방(fcc) 암염(NaCl) 격자 구조를 가지며, 격자 매개변수는 다음과 같다:[6]
더 큰 할로겐화물 이온은 입방 최밀 충전으로 배열되고, 더 작은 은 이온은 그 사이의 팔면체 간극을 채워 6배위 구조를 이룬다. 여기서 은 이온 Ag+는 6개의 Br− 이온에 둘러싸여 있고, 그 반대도 마찬가지이다. NaCl 구조에서의 AgBr에 대한 배위 기하학은 Ag(I)에 대해 예상치 못한 것으로, 이는 일반적으로 선형, 삼각(3배위 Ag) 또는 사면체(4배위 Ag) 착체를 형성한다.
할로겐화 은은 광범위한 용해도를 가진다. AgF의 용해도는 AgI의 약 6 × 107배이다. 이러한 차이는 할로겐 이온의 상대적인 용매화 엔탈피에 기인하며, 불화물의 용매화 엔탈피는 이례적으로 크다.[7]
브로민화 은을 녹는점으로부터 100°C 이내로 가열하면, 이온 전도도의 아레니우스 플롯이 값이 증가하고 "위쪽으로 꺾이는" 모습을 보인다. 탄성 계수, 비열, 전자 에너지 갭과 같은 다른 물리적 특성 또한 증가하여 결정이 불안정해지고 있음을 시사한다.[9] 이러한 현상은 반도체의 전형적인 특성으로, 프렌켈 결함 형성에 대한 온도 의존성에 기인하며, 프렌켈 결함의 농도에 따라 정규화하면 아레니우스 플롯이 선형화된다.[9]
3. 3. 결정 구조
브로민화 은 결정은 염화 나트륨형 구조이며, 격자 상수는 a = 5.768 Å이고, Ag-Br 결합 거리는 2.88 Å이다.[18]AgF, AgCl, AgBr은 모두 면심 입방(fcc) 암염(NaCl) 격자 구조를 가지며, 격자 매개변수는 다음과 같다.[6]
더 큰 할로젠화물 이온은 입방 최밀 충전으로 배열되고, 더 작은 은 이온은 그 사이의 팔면체 간극을 채워 6배위 구조를 이룬다. 여기서 은 이온 Ag+는 6개의 Br− 이온에 둘러싸여 있고, 그 반대도 마찬가지이다. NaCl 구조에서 AgBr의 배위 기하학은 Ag(I)에 대해 예상치 못한 것으로, Ag(I)는 일반적으로 선형, 삼각(3배위 Ag) 또는 사면체(4배위 Ag) 착물을 형성한다.
다른 할로젠화 은과는 달리, 요오드은석(AgI)은 육방 아연석 격자 구조를 갖는다.
4. 감광 메커니즘
1800년대 중반부터 사진 기술이 발전했지만, 1938년 R.W. 거니와 N.F. 모트의 논문이 나오기 전까지는 감광 현상을 제대로 설명하지 못했다.[8] 이 논문은 할로겐화 은, 특히 브로민화 은의 감광 현상에 대한 많은 연구를 이끌었다.[2]
이후 연구를 통해 브로민화 은의 사진 특성은 완벽한 결정 구조가 아닌 결함 때문에 나타난다는 것이 밝혀졌다. 결정 성장, 불순물, 표면 결함과 같은 요소들은 점 이온 결함과 전자 트랩의 수에 영향을 주어 빛에 대한 민감도를 변화시키고, 잠상이 형성되도록 한다.[3]
결정 표면에서 생성된 홀-복합체는 농도 기울기의 영향으로 결정 표면으로 이동한다. 결정 표면 근처에서 홀의 수명이 더 길고, 이 홀들은 흡착된 브롬과 평형을 이룬다. 이 평형은 표면에서 더 많은 홀을 생성하도록 유도하며, 홀-복합체가 표면에 도달하면 다음과 같이 분해된다:[10]
:h.Agv− → h• + Agv− → Br → FRACTION Br2
이 반응은 홀-복합체를 계속해서 소모시키며, 이는 결정에서 제거될 때까지 지속된다. 이 메커니즘은 간극의 Agi+가 Agi0으로 환원되는 반응과 함께 작용하며, 전체 반응식은 다음과 같다:[10]
:AgBr → Ag + FRACTION Br2
사진 필름이 이미지에 노출되면, 결정에 닿는 빛은 전자를 생성하고, 이 전자는 은 금속을 형성하기 위해 상호 작용한다. 특정 결정에 더 많은 빛이 닿으면 은 원자 농도가 더 커져서, 유제 감도에 따라 5~50개의 은 원자를 포함하는 은 원자 덩어리(잠상)를 만든다. 필름은 빛의 세기에 따라 은 원자 덩어리의 농도 기울기를 가지게 된다.[2][10] 이 과정에서 생성된 브롬은 유제 상단의 감광제가 흡수한다.[10]
필름 현상 과정에서 하이드로퀴논과 같은 화학 물질을 첨가하여 잠상을 강화한다. 이 화학 물질은 은 원자를 포함하는 결정을 선택적으로 환원시켜 잠상을 1010에서 1011배 정도 강화한다. 이는 할로겐화 은이 다른 시스템에 비해 가지는 장점이다.[2]
현상 후에는 필름을 "정착"시킨다. 티오황산나트륨을 사용하여 남아있는 은 염을 제거하여 더 이상 환원되지 않도록 하고, 필름에 "네거티브" 이미지를 남긴다.[2]
:AgX(s) + 2 Na2S2O3(aq) → Na3[Ag(S2O3)2](aq) + NaX(aq)
네거티브를 통해 빛을 비추고 위에서 설명한 단계를 반복하면 여러 장의 포지티브 인쇄물을 만들 수 있다.[2]
사진 감광제로 브로민화 은을 만들 때, 젤라틴과 같은 보호 콜로이드를 넣은 수용액에서 브로민화 칼륨 수용액과 질산 은 수용액을 섞는다. 이때, 용액 속 은 이온 농도(pAg)를 조절하는 것이 중요하다. 젤라틴 농도가 충분하고 은 이온 농도가 낮으면 정팔면체 결정이 만들어진다. 최근에는 쌍정면을 두 개 이상 포함하는 평판 입자가 필름용으로 많이 사용된다.
4. 1. 프렌켈 결함
할로겐화 은(특히 AgBr)의 주요 결함은 프렌켈 결함이다. 이는 은 이온이 격자 사이(간극, interstitial)에 위치(Agi+)하고, 원래 은 이온이 있어야 할 자리에 빈 공간(은 이온 공공, Agv−)이 생기는 현상이다.[3] AgBr 프렌켈 쌍의 특징은 간극에 있는 Agi+가 매우 잘 움직인다는 점과, 결정 표면 근처 층(공간 전하층)에서의 농도가 결정 내부보다 훨씬 높다는 것이다.[3][9] 프렌켈 쌍 형성 에너지는 1.16 eV로 낮고, 이동 활성화 에너지는 0.05 eV로 매우 낮다. 이러한 낮은 에너지 값 때문에 결함 농도가 높아질 수 있다.[9]브로민화 은의 낮은 활성화 에너지는 은 이온의 높은 4중극 편극성, 즉 모양이 쉽게 변형될 수 있는 성질 때문이다. 은 이온의 d9 전자 구조 때문에 은 이온과 은 이온 공공 모두 이동하기 쉬워져서 이동 에너지가 낮아진다.[9]
결함 농도는 결정 크기에 영향을 받는데, 대부분의 결함은 결정 크기에 반비례하지만, 공공 결함은 비례한다. 불순물 농도는 결정 성장 과정이나 용액에 불순물을 넣어 조절할 수 있다. 브로민화 은 격자에 불순물이 있으면 프렌켈 결함 형성에 영향을 주지만, 특정 농도 이상에서는 간극 은 이온과 양의 킨크 수가 감소하고, 은 이온 공공 결함이 증가한다.[3]
4. 2. 전자 트랩과 정공 트랩
브로민화 은 결정 표면에 빛이 닿으면 광전자가 생성되고, 할로겐은 전자를 전도대로 잃는다.[2][3][10]:X− + hν → X + e−
방출된 전자는 간극의 Agi+와 결합하여 은 금속 원자 Agi0을 생성한다.[2][3][10]
:e− + Agi+ → Agi0
결정 내 결함으로 인해 전자는 에너지를 줄이고 원자에 갇힐 수 있다.[2] 결정립 경계와 결함 정도는 광전자 수명에 영향을 주며, 결함이 많은 결정은 순수한 결정보다 전자를 더 빨리 가둔다.[10]
광전자가 이동하면 광홀(h•)도 생성되는데, 이 역시 중화되어야 한다. 광홀의 수명은 광전자와 상관관계가 없으며, 이는 다른 트랩 메커니즘을 시사한다. 말리노프스키(Malinowski)는 홀 트랩이 불순물로 인한 결함과 관련이 있을 수 있다고 제안한다.[10] 갇힌 홀은 격자 내 이동성이 있는 음전하 결함인 간극 은 공공(Agv−)을 끌어당긴다.[10]
:h• + Agv− h.Agv
h.Agv 형성은 복합체를 안정화시키고 홀이 원자가대로 방출될 확률을 줄인다(결정 내부 홀-복합체 평형 상수는 10−4로 추정).[10]
전자 및 홀 트래핑에 대한 추가 연구에 따르면 불순물도 중요한 트래핑 시스템이 될 수 있다. 따라서 간극 은 이온이 감소하지 않을 수 있다. 이러한 트랩은 손실 메커니즘이며, 트래핑 비효율성으로 간주된다. 예를 들어, 대기 중 산소는 광전자와 상호 작용하여 O2− 종을 형성하고, 이는 홀과 상호 작용하여 복합체를 반전시키고 재결합을 겪을 수 있다. 구리(I), 철(II), 카드뮴(II)과 같은 금속 이온 불순물은 브로민화 은에서 홀 트래핑을 나타냈다.[3]
4. 3. 잠상 형성
1800년대 중반부터 사진 공정이 개발되었지만, 1938년 R.W. 거니(R.W. Gurney)와 N.F. 모트(N.F. Mott)의 논문이 발표되기 전까지는 그 원리가 명확하게 밝혀지지 않았다.[8] 이들의 연구는 할로겐화 은, 특히 브로민화 은(AgBr)의 감광 현상에 대한 더 많은 연구를 촉발시켰다.[2]브로민화 은의 사진 특성은 결정 구조의 결함에서 비롯된다. 결정 성장, 불순물, 표면 결함 등은 점 이온 결함 및 전자 트랩 농도에 영향을 미쳐 빛에 대한 감도를 높이고 잠상 형성을 가능하게 한다.[3]
프렌켈 결함과 전자/정공 트랩브로민화 은의 주요 결함은 프렌켈 결함이다. 이는 은 이온(Ag+)이 원래 위치에서 벗어나 격자 사이(간극)에 위치(Agi+)하면서, 원래 자리에 빈자리(Agv−)가 생기는 현상이다. AgBr에서 간극 Agi+는 매우 잘 움직이며, 결정 표면 근처 농도가 매우 높다.[3][9] 프렌켈 쌍 형성 에너지는 낮고(1.16 eV), 이동 활성화 에너지도 매우 낮아(0.05 eV) 결함 농도가 높다.[9]
브로민화 은의 낮은 활성화 에너지는 은 이온의 높은 4중극 편극성(쉽게 변형되는 성질) 때문이다. 은 이온의 d9 전자 구조는 은 이온과 은 이온 공공의 이동을 쉽게 하여 이동 에너지를 낮춘다.[9]
결정 크기에 따라 결함 농도가 크게 달라진다. 간극 은 이온 등의 결함은 결정 크기에 반비례하지만, 공공 결함은 비례한다. 이는 표면 화학 평형 변화 때문이다.[3] 불순물 농도는 결정 성장 과정에서 조절할 수 있다. 특정 농도 이상에서는 간극 은 이온 수가 급격히 감소하고, 은 이온 공공 결함만 증가한다.[3]
빛이 브로민화 은 결정에 닿으면 광전자가 생성된다.[2][3][10]
:X− + hν → X + e−
이 전자는 간극 Agi+와 결합하여 은 금속 원자(Agi0)를 만든다.[2][3][10]
:e− + Agi+ → Agi0
결정 내 결함은 전자를 가두는 역할을 한다. 결함이 많을수록 전자는 더 빨리 갇힌다.[10] 광전자가 이동하면 광홀(h•)도 생성되는데, 이 역시 중화되어야 한다. 광홀 트랩은 불순물과 관련 있을 수 있다.[10] 갇힌 홀은 격자 내 이동성 음전하 결함인 간극 은 공공(Agv−)을 끌어당긴다.[10]
:h• + Agv− h.Agv
h.Agv 형성은 홀이 다시 원자가대로 방출될 확률을 줄인다.[10] 불순물은 전자와 홀 모두에게 중요한 트랩이 될 수 있다. 대기 중 산소는 광전자와 반응하여 홀과 상호작용하는 O2−를 형성할 수 있다. 구리(I), 철(II), 카드뮴(II) 등도 브로민화 은에서 홀 트랩을 보여준다.[3]
결정 표면 화학 및 잠상 형성홀-복합체(h.Agv)는 농도 기울기에 따라 결정 표면으로 확산된다. 표면 근처 홀의 수명은 길고, 흡착된 브롬과 평형을 이룬다. 표면에서 평형 반응에 의해 홀-복합체는 지속적으로 소모된다.[10]
:h.Agv− → h• + Agv− → Br → FRACTION Br2
이 메커니즘은 간극 Agi+가 Agi0으로 환원되는 것과 함께 작용한다.[10]
:AgBr → Ag + FRACTION Br2
사진 필름이 빛에 노출되면, 빛의 세기에 따라 결정립에 은 원자 덩어리(잠상)가 형성된다. 유제 감도에 따라 5~50개의 은 원자가 모이면 잠상이 된다.[2][10] 이 과정에서 생성된 브롬은 유제 상층의 감광제가 흡수한다.[10]
필름 현상 과정에서 하이드로퀴논 등의 화학 물질은 은 원자를 포함하는 결정립을 선택적으로 환원시켜 잠상을 강화한다. 이 과정은 잠상을 1010~1011배 강화한다.[2] 현상 후, 티오황산나트륨으로 정착하여 남은 은 염을 제거하고 네거티브 이미지를 만든다.[2]
:AgX(s) + 2 Na2S2O3(aq) → Na3[Ag(S2O3)2](aq) + NaX(aq)
5. 사진술에서의 이용
브로민화 은은 사진 감광제로 널리 사용된다.
5. 1. 사진 필름 및 인화지
사진 감광제로 브로민화 은을 생성하는 경우, 양질의 결정을 침전시키기 위해 젤라틴 등의 보호 콜로이드를 넣은 수용액 중에서, 연속적으로 교반하면서, 브로민화 칼륨 수용액과 질산 은 수용액을 동시에 혼입한다. 이때, 유입 속도를 조절하여, 소정의 수용액 중 은 이온 농도 프로파일을 유지한다. 이 값은 통상 대수값을 취하여 pAg라고 불리는데, 매우 중요한 변수이다. 젤라틴 농도가 충분하고, 은 이온 농도가 충분히 낮은 조건에서는, 정팔면체 결정이 얻어진다. 최근에는, 쌍정면을 두 개 이상 포함하는 평판 입자가 특히 필름용으로 많이 사용된다.참조
[1]
서적
Chemical Principles 6th Ed.
Houghton Mifflin Company
[2]
서적
Chemistry of the Elements
Permagon Press
[3]
논문
Physical Properties of Silver Halide Microcrystals
[4]
논문
The Solubility of Silver Chloride and Silver Bromide in Aqueous Ammonia and the Formation of Mixed Silver-Ammonia-Halide Complexes
[5]
논문
Lewis-Base Adducts of Group-11 Metal(I) Compounds. XXX. 3:1 Complexes of Triphenylphosphine With Silver(I) Halides
[6]
논문
The band structures of the silver halides AgF, AgCl, and AgBr: A comparative study
[7]
간행물
Handbook of Chemistry and Physics
The Chemical Rubber Publishing Co.
2005
[8]
논문
The theory of the photolysis of silver bromide and the photographic latent image
[9]
논문
The Physics of Lattice Defects in Silver Halides
[10]
논문
The Role of Holes in the Photographic Process
[11]
간행물
The NBS tables of chemical thermodynamics properties
R.I. Nuttal, K.L. Churney and R.I. Nuttal
1982
[12]
서적
基礎分析化学
三共出版
[13]
서적
化学大辞典
共立出版
[14]
서적
Chemical Principles 6th Ed.
https://archive.org/[...]
Houghton Mifflin Company
[15]
서적
Chemistry of the Elements
Permagon Press
[16]
논문
The Solubility of Silver Chloride and Silver Bromide in Aqueous Ammonia and the Formation of Mixed Silver-Ammonia-Halide Complexes.
[17]
논문
Lewis-Base Adducts of Group-11 Metal(I) Compounds. XXX. 3:1 Complexes of Triphenylphosphine With Silver(I) Halides
[18]
서적
化学大辞典
共立出版
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com